هيدروكسيدات: الخصائص ، التسميات والأمثلة
هيدروكسيدات هي مركبات غير عضوية وثلاثية تتكون من التفاعل بين الكاتيون المعدني والمجموعة الوظيفية OH (أنيون هيدروكسيد ، OH-). معظمهم أيوني بطبيعته ، على الرغم من أنه يمكن أن يكون لهم روابط تساهمية.
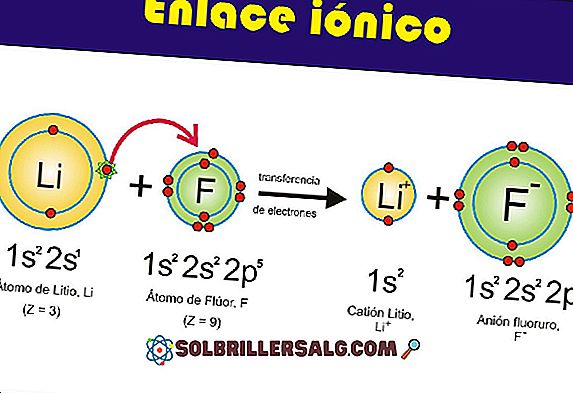
على سبيل المثال ، يمكن تمثيل هيدروكسيد على أنه تفاعل إلكتروستاتيكي بين الكاتيون M + والكربون ، أو كرابطة تساهمية عبر رابطة M-OH (الصورة السفلى). في الأول ، يتم إعطاء الرابطة الأيونية ، بينما في الرابطة الثانية ، الرابطة التساهمية. تعتمد هذه الحقيقة بشكل أساسي على المعدن أو الكاتيون M + ، وكذلك نصف قطر الشحنة والأيونية.

لأن معظمها يأتي من المعادن ، وهو ما يعادل ذكرها على أنها هيدروكسيدات المعادن.
كيف يتم تشكيلها؟
يوجد طريقان رئيسيان اصطناعيان: عن طريق تفاعل الأكسيد المقابل مع الماء ، أو مع وجود قاعدة قوية في الوسط الحمضي:
MO + H 2 O => M (OH) 2
MO + H + + OH- => M (OH) 2
تتفاعل أكاسيد الفلزات القابلة للذوبان في الماء مباشرة لتكوين هيدروكسيد (المعادلة الكيميائية الأولى). البعض الآخر غير قابل للذوبان ويتطلب الأنواع الحمضية التي تطلق M + ، والتي تتفاعل بعد ذلك مع OH- من القواعد القوية (المعادلة الكيميائية الثانية).
ومع ذلك ، فإن القواعد القوية المذكورة هي هيدروكسيدات المعادن NaOH ، KOH وغيرها من مجموعة المعادن القلوية (LiOH ، RbOH ، CsOH). هذه المركبات الأيونية شديدة الذوبان في الماء ، وبالتالي فإن أحماضها الهيدروجينية أحرار في المشاركة في التفاعلات الكيميائية.
من ناحية أخرى ، توجد هيدروكسيدات المعادن غير القابلة للذوبان ، وبالتالي فهي قواعد ضعيفة للغاية. حتى أن بعضها حمضي ، كما هو الحال مع حمض التيلوريك ، Te (OH) 6 .
يؤسس هيدروكسيد توازن الذوبان مع المذيب المحيط به. إذا كان الماء ، على سبيل المثال ، يتم التعبير عن الرصيد على النحو التالي:
M (OH) 2 M2 + (ac) + OH- (ac)
حيث تشير (ac) إلى أن الوسط مائي. عندما تكون المادة الصلبة غير قابلة للذوبان ، يكون تركيز OH الذائب صغيرًا أو لا يكاد يذكر. لهذا السبب ، لا يمكن أن تنتج هيدروكسيدات الفلزات غير القابلة للذوبان حلولًا أساسية مثل تلك الخاصة بـ NaOH.
مما سبق ، يمكن استنتاج أن الهيدروكسيدات تظهر خواص مختلفة تمامًا ، مرتبطة بالبنية الكيميائية والتفاعلات بين المعدن وأوهايو. وهكذا ، على الرغم من أن الكثير منها أيوني ، له هياكل بلورية متنوعة ، فإن البعض الآخر من ناحية أخرى له هياكل بوليمرية معقدة وغير منظمة.
خصائص هيدروكسيدات
أنيون أوهايو
أيون الهيدروكسيل هو ذرة أكسجين مرتبطة تساهميًا بالهيدروجين. وبالتالي ، يمكن تمثيل هذا بسهولة كـ OH-. توجد الشحنة السلبية على الأكسجين ، مما يجعل هذا الأنيون نوعًا من التبرعات بالإلكترون: قاعدة.
إذا تبرعت OH بالإلكترونات الخاصة بها إلى هيدروجين ، يتشكل جزيء من H2 O ، ويمكنها أيضًا أن تتبرع بإلكتروناتها للأنواع المشحونة إيجابياً: مثل المراكز المعدنية M +. وبالتالي ، يتم تشكيل مجمع التنسيق من خلال الرابط السالب M-OH (الأكسجين يساهم في زوج الإلكترونات).
ومع ذلك ، لكي يحدث ذلك ، يجب أن يكون الأكسجين قادرًا على التنسيق بكفاءة مع المعدن ، وإلا ، فإن التفاعلات بين M و OH سيكون لها طابع أيوني ملحوظ (M + OH-). نظرًا لأن أيون الهيدروكسيل هو نفسه في جميع الهيدروكسيدات ، فإن الفرق بينها جميعًا يكمن في الكاتيون المصاحب لها.
أيضًا ، نظرًا لأن هذا الكاتيون يمكن أن يأتي من أي فلز في الجدول الدوري (المجموعات 1 ، 2 ، 13 ، 14 ، 15 ، 16 ، أو من الفلزات الانتقالية) ، تختلف خصائص هذه الهيدروكسيدات بشكل كبير ، على الرغم من أنها جميعًا تفكر فيها المشتركة بعض الجوانب.
شخصية أيونية وأساسية
في هيدروكسيدات ، على الرغم من أن لها روابط تنسيق ، إلا أنها ذات طابع أيوني كامن. في البعض ، مثل NaOH ، تشكل أيوناتها جزءًا من شبكة بلورية تتكون من Na + cation و OH-anions بنسب 1: 1 ؛ أي لكل Na + يوجد نظير OH.
اعتمادًا على التحميل المعدني ، سيكون هناك عدد أكبر أو أقل من الأدوات المحيطة به. على سبيل المثال ، بالنسبة إلى الكاتيون المعدني M2 + ، سيكون هناك أيون OH- يتفاعلان معها: M (OH) 2 ، والذي تم تحديده على أنه HO-M2 + OH-. يحدث الشيء نفسه مع المعادن M3 + وغيرها مع شحنات أكثر إيجابية (على الرغم من نادرا ما تتجاوز 3+).
هذه الشخصية الأيونية مسؤولة عن العديد من الخواص الفيزيائية ، مثل نقاط الانصهار والغليان. هذه عالية ، مما يعكس القوى الإلكتروستاتيكية التي تعمل داخل الشبكة البلورية. وبالمثل ، عندما يتم إذابة هيدروكسيدات أو إذابته ، فيمكنه إجراء التيار الكهربائي بسبب تنقل أيوناته.
ومع ذلك ، ليس كل هيدروكسيدات لديها نفس الشبكات البلورية. أولئك الذين لديهم أكثر الثباتات سيكونون أقل عرضة للذوبان في المذيبات القطبية مثل الماء. كقاعدة عامة ، كلما زاد تباين نصف قطر أيون M + و OH- ، كلما كانت أكثر قابلية للذوبان.
الاتجاه الدوري
يوضح ما سبق سبب زيادة قابلية ذوبان هيدروكسيدات الفلزات القلوية مع هبوط المجموعة. وبالتالي ، فإن الترتيب المتزايد للذوبان في الماء لهذه هي ما يلي: LiOH OH- هو أنيون صغير ، وبما أن الكاتيون يصبح أكثر كثافة ، فإن الشبكة البلورية تضعف بقوة. من ناحية أخرى ، تشكل المعادن الأرضية القلوية هيدروكسيدات أقل قابلية للذوبان بسبب الشحنات الإيجابية العالية. وذلك لأن M2 + يجذب OH- بقوة أكبر مقارنة بـ M +. وبالمثل ، فإن الكاتيونات أصغر حجمًا ، وبالتالي فهي غير متساوية في الحجم فيما يتعلق بـ OH. نتيجة هذا هو الدليل التجريبي على أن NaOH هو أكثر أساسية بكثير من Ca (OH) 2 . يمكن تطبيق نفس المنطق على هيدروكسيدات أخرى ، إما تلك الخاصة بالمعادن الانتقالية ، أو للمعادن الموجودة في الكتلة p (Al ، Pb ، Te ، إلخ). وأيضًا ، كلما كان نصف قطر الأيونات الأصغر والأكبر والشحنة الموجبة لـ M + ، كلما انخفض الطابع الأيوني لهيدروكسيد ، بمعنى آخر ، أولئك الذين لديهم كثافة شحن عالية للغاية. مثال على ذلك يحدث مع هيدروكسيد البريليوم ، Be (OH) 2 . Be2 + هو كاتيون صغير للغاية وشحنته المزدوجة تجعله كثيفًا جدًا كهربائيًا. تتفاعل الهيدروكسيدات M (OH) 2 مع الأحماض لتشكيل مركب مائي ، أي نهايات M + المحاطة بجزيئات الماء. ومع ذلك ، هناك عدد محدود من هيدروكسيدات التي يمكن أن تتفاعل أيضا مع القواعد. هذه هي ما تعرف باسم هيدروكسيدات مذبذب. تتفاعل هيدروكسيدات الأمفوتريك مع كل من الأحماض والقواعد. يمكن تمثيل الحالة الثانية بالمعادلة الكيميائية التالية: M (OH) 2 + OH- => M (OH) 3 - ولكن كيف يمكن تحديد ما إذا كان الهيدروكسيد مذبذبًا؟ من خلال تجربة معملية بسيطة. نظرًا لأن العديد من هيدروكسيدات المعادن غير قابلة للذوبان في الماء ، عن طريق إضافة قاعدة قوية إلى محلول مع أيونات M + الذائبة ، على سبيل المثال ، Al3 + ، فإن الهيدروكسيد المقابل سوف يترسب: Al3 + (ac) + 3OH- (ac) => Al (OH) 3 (s) ولكن وجود فائض من OH- هيدروكسيد يستمر في التفاعل: Al (OH) 3 (s) + OH- => Al (OH) 4 - (ac) نتيجة لذلك ، يتم تحميص المركب السلبي الجديد بواسطة جزيئات الماء المحيطة ، إذابة المادة الصلبة البيضاء من هيدروكسيد الألومنيوم. لا تتصرف هيدروكسيدات تلك التي تظل كما هي مع إضافة قاعدة إضافية مثل الأحماض ، وبالتالي فهي ليست مبيضة. قد يكون للهيدروكسيدات هياكل بلورية مماثلة لتلك الموجودة في العديد من الأملاح أو الأكاسيد ؛ بعض بسيطة ، والبعض الآخر معقد للغاية. بالإضافة إلى ذلك ، يمكن لتلك التي يوجد فيها انخفاض في الطابع الأيوني تقديم مراكز معدنية مرتبطة بجسور الأكسجين (HOM-O-MOH). في الحل الهياكل مختلفة. على الرغم من أن هيدروكسيدات الذوبان للغاية ، يكفي اعتبارها أيونات مذابة في الماء ، لكن بالنسبة للآخرين ، من الضروري مراعاة كيمياء التنسيق. وبالتالي ، يمكن تنسيق كل م + كاتيون لعدد محدود من الأنواع. وكلما زاد حجمها ، زاد عدد جزيئات الماء أو OH المرتبطة بها. ومن ثم فإن مجسم التنسيق الشهير للعديد من الفلزات الذائبة في الماء (أو في أي مذيب آخر): M (OH 2 ) 6 + n ، تساوي الشحنة الموجبة للمعادن. Cr (OH) 3 ، على سبيل المثال ، في الواقع يشكل مجسم مجسم. كيف؟ بالنظر إلى المركب على أنه [Cr (OH 2 ) 3 (OH) 3 ] ، والذي تم استبدال ثلاثة من جزيئات الماء به OH. إذا تم استبدال جميع الجزيئات بـ OH- ، فسيتم الحصول على مركب الشحنة السالبة وهيكل الأوكتاهدرا [Cr (OH) 6 ] 3-. التهمة -3 هي نتيجة الشحنات السلبية الستة لـ OH-. يمكن اعتبار هيدروكسيدات "أكاسيد مائية". ومع ذلك ، في "الماء" في اتصال مباشر مع M + ؛ أثناء وجود أكاسيد الماء MO 2 nH ، تكون جزيئات الماء جزءًا من مجال التنسيق الخارجي (فهي ليست قريبة من المعدن). يمكن استخراج جزيئات الماء المذكورة من خلال تسخين عينة هيدروكسيد: M (OH) 2 + Q (حرارة) => MO + H 2 O MO هو أكسيد المعادن المتكون نتيجة للجفاف هيدروكسيد. مثال على هذا التفاعل هو الملاحظة عند هيدروكسيد الكبريت ، Cu (OH) 2 ، المجففة: Cu (OH) 2 (أزرق) + Q => CuO (أسود) + H 2 O ما هي الطريقة الصحيحة لذكر هيدروكسيدات؟ اقترح IUPAC ثلاثة تسميات لهذا الغرض: التقليدية ، والأوراق المالية ، ومنهجية. من الصحيح استخدام أي من العناصر الثلاثة ، ولكن بالنسبة لبعض هيدروكسيدات قد يكون من المناسب أو العملي ذكرها بطريقة أو بأخرى. تتكون التسمية التقليدية ببساطة من إضافة اللاحقة -ico إلى أعلى التكافؤ الذي يقدمه المعدن ؛ واللاحقة -oso إلى الأدنى. وهكذا ، على سبيل المثال ، إذا كان المعدن M يحتوي على تكافؤ +3 و +1 ، فسيتم تسمية هيدروكسيد M (OH) 3 هيدروكسيد (اسم المعدن) ico ، بينما دب هيدروكسيد وزارة الصحة (اسم المعدن). لتحديد تكافؤ المعدن في هيدروكسيد ، يكفي مراقبة العدد بعد OH الموجود بين قوسين. وبالتالي ، يعني M (OH) 5 أن المعدن له شحنة أو تكافؤ +5. لكن العيب الرئيسي لهذه التسمية هو أنه يمكن أن يكون معقدًا بالنسبة للمعادن التي تحتوي على أكثر من حالتين للأكسدة (كما هو الحال مع الكروم والمنغنيز). في مثل هذه الحالات ، يتم استخدام البادئات الفائقة ونقص التنوير للدلالة على أعلى وأدنى التكافؤ. وبالتالي ، إذا كانت M بدلاً من وجود قيم التكافؤ +3 و +1 فقط ، فإن لها أيضًا +4 و +2 ، فإن أسماء هيدروكسيداتها ذات القيم العالية والسفلى هي: هيدروكسيد مفرط (اسم المعدن) ico وهيدروكسيد هيبوكسيد ( اسم المعدن) الدب . من بين كل التسميات هذا هو الأبسط. هنا يتبع اسم هيدروكسيد ببساطة تكافؤ المعدن المحاط بالأقواس والمكتوب بالأرقام الرومانية. مرة أخرى بالنسبة لـ M (OH) 5 ، على سبيل المثال ، فإن تسمية مخزونها هي: هيدروكسيد (اسم المعدن) (V). (V) يدل على ذلك (+5). أخيرًا ، تتميز التسمية المنهجية باللجوء إلى بادئات مضاعفة (ثنائية أو ثلاثية أو رباعية أو خماسية أو سداسية أو ما إلى ذلك). يتم استخدام هذه البادئات لتحديد عدد ذرات المعادن والأكسجين. وبهذه الطريقة ، يتم تسمية M (OH) 5 باسم: pentahydroxide (اسم المعدن). بالنسبة لحالة الزئبق 2 (OH) 2 ، على سبيل المثال ، سيكون ثنائي هيدروكسيد ثنائي الدركوريوم ؛ أحد هيدروكسيدات التي يكون تركيبها الكيميائي معقدًا للوهلة الأولى. بعض الأمثلة على هيدروكسيدات وتسمياتها المقابلة هي تلك التي تتبع: - NaOH (هيدروكسيد الصوديوم)تذبذبية التفاعل
الهياكل
رد فعل الجفاف
تسمية
تقليدي
الأوراق المالية
النظاميات
أمثلة على هيدروكسيدات

-Ca (OH) 2 (هيدروكسيد الكالسيوم)

- Fe (OH) 3. ( هيدروكسيد الحديديك ، هيدروكسيد الحديد (III) ، أو ثلاثي هيدروكسيد الحديد)
-V (OH) 5 ( هيدروكسيد منتشر أو هيدروكسيد الفاناديوم (V) أو الفاناديوم بنتاهيدروكسيد).
-Sn (OH) 4 ( هيدروكسيد ثابت ، هيدروكسيد القصدير (IV) ، أو رباعي هيدروكسيد القصدير).
-با (OH) 2 (هيدروكسيد الباريوم أو ديهيدروكسيد الباريوم).
- مليون (OH) 6 ( هيدروكسيد المنغنيز ، هيدروكسيد المنغنيز (VI) أو هيكساهيدروكسيد المنغنيز).
-AgOH (هيدروكسيد الفضة ، هيدروكسيد الفضة أو هيدروكسيد الفضة). لاحظ أنه بالنسبة لهذا المركب لا يوجد تمييز بين الأسهم والتسميات المنهجية.
-Pb (OH) 4 ( هيدروكسيد Plúmbico ، هيدروكسيد الرصاص (IV) أو رباعي هيدروكسيد الرصاص).
-LiOP (هيدروكسيد الليثيوم).
-Cd (OH) 2 (هيدروكسيد الكادميوم)
با (OH) 2 ( هيدروكسيد الباريوم)
هيدروكسيد الكروم