الكاتيون: التكوين ، الاختلافات مع أنيون والأمثلة
الكاتيون هو نوع كيميائي له شحنة موجبة. يتوافق مع أنيون نوعين من الأيونات الموجودة. إن شحنتها هي نتاج نقص الإلكترونات في الذرة ، مما يتسبب في زيادة تأثير البروتونات في النواة. لكل إلكترون تفقده ذرة محايدة ، تزداد الشحنة الموجبة في الوحدة.
إذا فقدت ذرة إلكترونًا ، وبالتالي فإن عدد البروتونات أكبر من واحد ، فإن شحنتها الإيجابية ستكون +1 ؛ إذا فقدت إلكترونين ، فستكون الشحنة +2 ، وهكذا. عندما يكون للكاتيون شحنة +1 ، يُقال إنه أحادي التكافؤ ؛ من ناحية أخرى ، إذا كانت الشحنة أكبر من +1 ، يقال إن الكاتيون متعدد التكافؤ.

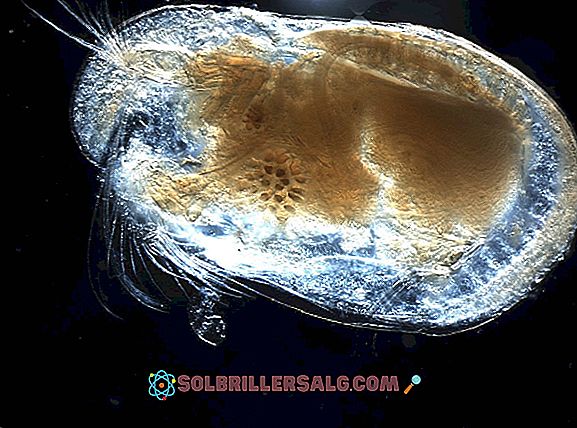
تُظهر الصورة العلوية الكاتيون H 3 O + ، والذي يُطلق عليه اسم أيون الهيدرونيوم. كما يمكن أن يرى ، فإنه بالكاد يشحن 1+ ، وبالتالي فهو كاتيون أحادي التكافؤ.
الكاتيونات هي أنواع مهمة ، لأنها تمارس قوة كهروستاتيكية مع بيئتها والجزيئات المحيطة بها. لديهم تفاعل عال مع الماء ، وهو سائل يرطبه وينقله في التربة الرطبة ، للوصول في وقت لاحق إلى جذور النباتات واستخدامه في وظائفهم الفسيولوجية.
كيف يتم تشكيل الكاتيون؟
وذُكر أنه عندما تفقد ذرة إلكترون ، فإن عددها الأكبر من البروتونات ، فيما يتعلق بالإلكترونات ، يبذل قوة جذابة تترجم إلى شحنة موجبة. ولكن كيف يمكن أن يحدث فقدان الإلكترون؟ الجواب يعتمد على التحول الذي حدث في التفاعلات الكيميائية.
تجدر الإشارة إلى أن وجود ذرة موجبة الشحنة لا يعني بالضرورة تكوين الكاتيون. من أجل اعتبار ذلك ، يجب ألا تكون هناك ذرة ذات شحنة رسمية سالبة تحيدها. خلاف ذلك ، سيكون هناك جاذبية وصد داخل نفس المركب وسيكون محايدًا.
رسوم رسمية والمزيد من الروابط
تستقطب الذرات الإلكترونية الإلكترونات من روابطها التساهمية. على الرغم من أن الإلكترونات مشتركة على قدم المساواة ، إلا أن هناك نقطة سيكون فيها إلكترونات أقل جزئياً من الإلكترونات القاعدية ؛ هذا هو ذراته الحرة دون أن يرتبط بعناصر أخرى.
ثم ، ستبدأ هذه الذرات الكهربية بتجربة نقص في الإلكترونات ، وبهذا ، ستتمتع بروتونات نواتها بقوة جذب أكبر ؛ يولد شحنة رسمية إيجابية. إذا كان هناك شحنة رسمية موجبة واحدة فقط ، فسيظهر المركب شحنة أيونية موجبة عالمية ؛ هكذا وُلد الكاتيون.
ذرة الأكسجين في H 3 O + الموجبة هي مثال مخلص لما سبق ذكره. وجود ثلاث روابط OH ، واحدة أكثر مما كانت عليه في جزيء الماء (HOH) ، تختبر مشاركة فقدان الإلكترون فيما يتعلق بحالته القاعدية. تسمح حسابات الرسوم الرسمية بتحديد وقت حدوث ذلك.
إذا تم افتراض تكوين رابطة OH أخرى للحظة ، فسيتم الحصول على الكاتيون ثنائي التكافؤ H 4 O 2 +. لاحظ أنه يتم كتابة الشحنة ثنائية التكافؤ الموجودة أعلى الكاتيون على النحو التالي: الرقم متبوعًا بالرمز "+" ؛ وبالمثل ، يتم استخدام الأنيونات.
أكسدة
المعادن هي الكاتيون صائغي بامتياز. ومع ذلك ، لا يمكن أن تشكل جميعها روابط تساهمية (أو على الأقل تساهمية بحتة). بدلاً من ذلك ، يفقدون الإلكترونات لإنشاء روابط أيونية: الشحنة الإيجابية تجذب سالبة ، متحدة بواسطة القوى المادية.
لذلك ، تفقد المعادن الإلكترونات للانتقال من M إلى Mn + ، حيث n تساوي عادة عدد مجموعتها في الجدول الدوري ؛ على الرغم من أن n يمكن أن يأخذ عدة قيم عددية ، والتي تحدث خاصة مع المعادن الانتقالية. يحدث فقدان الإلكترونات في نوع من التفاعل الكيميائي يسمى الأكسدة.
تتأكسد المعادن ، وتفقد الإلكترون ، وعدد البروتونات في ذراتها يتجاوز عدد الإلكترونات ، وبالتالي تظهر شحنة موجبة. لكي يكون هناك أكسدة ، يجب أن يكون هناك عامل مؤكسد ، مما يقلل أو يكسب الإلكترونات التي تفقدها المعادن. الأكسجين هو أفضل عامل مؤكسد معروف على الإطلاق.
الخلافات مع أنيون

فيما يلي الاختلافات بين الكاتيون والأنيون:
- الكاتيون بشكل عام أصغر من الأنيون. تُظهر الصورة العلوية كيف يتم تقليل نصف قطر ذرات المغنيسيوم من خلال فقدان إلكترونين وتصبح الكاتيونات Mg2 + ؛ يحدث العكس مع الأنيونات: تصبح أكثر ضخامة.
- يحتوي على عدد أكبر من البروتونات من الإلكترونات ، بينما يحتوي الأنيون على إلكترونات أكثر من البروتونات.
- أن تكون أصغر ، وكثافة الشحنة أعلى ، وبالتالي تتمتع بقوة استقطابية أكبر ؛ أي أنها تشوه السحب الإلكترونية للذرات المجاورة.
- الكاتيون يتحرك في نفس اتجاه الحقل الكهربائي المطبق ، بينما يتحرك الأنيون في الاتجاه المعاكس.
أمثلة على الكاتيونات الأكثر شيوعًا
أحادي القاعدة
معظم الكاتيونات الأحادية تأتي من المعادن (مع استثناءات معينة ، مثل H +). من الباقي ، من النادر للغاية التفكير في الكاتيون المستمد من عنصر غير معدني.
سيتبين أن العديد منهم ثنائي أو متعدد التكافؤ ، وأن حجم رسومهم يتفق مع عدد مجموعاتهم في الجدول الدوري.
لي +
-لا +
ك +
-Rb +
-C +
+ +
- +
تشترك جميعها في الحمل "1+" ، والذي يتم كتابته دون الحاجة إلى وضع الرقم ، كما أنه يأتي من المجموعة 1: المعادن القلوية. علاوة على ذلك ، هناك Ag + الكاتيون ، أحد أكثر الفلزات الانتقالية شيوعًا.
-Be2 +
-Mg2 +
-Ca2 +
SR2 +
-Ba2 +
-Ra2 +
هذه الكاتيونات ثنائية التكافؤ مستمدة من معادن كل منها تنتمي إلى المجموعة 2: المعادن الأرضية القلوية.
-Al3 +
- Ga3 +
-In3 +
-Tl3 +
-Nh3 +
الكاتيونات ثلاثية التكافؤ من مجموعة البورون.
حتى الآن تم وصف الأمثلة بأنها تحتوي على تكافؤ واحد أو تحميل واحد. تظهر الكاتيونات الأخرى أكثر من تكافؤ واحد أو حالة أكسدة موجبة:
-Sn2 +
-Sn4 + (القصدير)
-Co2 +
-Co3 + (الكوبالت)
-أو +
- + 3 (الذهب)
-Fe2 +
- Fe3 + (الحديد)
وغيرها من المعادن ، مثل المنجنيز ، لا يزال لديها الكثير من التكافؤ:
+2
-Mn3 +
-Mn4 +
+7
كلما كانت الشحنة أكبر ، كلما كان الكاتيون أصغر واستقطابًا.
متعدد الذرات
دون الخوض في الكيمياء العضوية ، هناك كيانات غير عضوية ومتعددة الذرات شائعة جدًا في الحياة اليومية ؛ مثل:
-H 3 O + (الهيدرونيوم ، سبق ذكره).
-NH 4 + (الأمونيوم).
-NO 2 + (النترونيوم ، موجود في عمليات النترات).
- PH 4 + (الفسفونيوم).