كيمياء
تصف قوانين قياس العناصر المتفاعلة تركيبة المواد المختلفة ، بناءً على العلاقات (في الكتلة) بين كل الأنواع التي تتدخل في التفاعل. تتشكل كل المادة الموجودة عن طريق الجمع ، بنسب مختلفة ، بين العناصر الكيميائية المختلفة التي تشكل الجدول الدوري. تخضع هذه النقابات لقوانين معيّنة تُعرف باسم "قوانين القياس الكيميائي" أو "قوانين الوزن في الكيمياء". هذه المبادئ هي جزء أساسي من الكيمياء الكمية ، كونها ضرورية لموازنة المعاد
الإيثاناميد مادة كيميائية تنتمي إلى مجموعة مركبات النيتروجين العضوية. كما يتلقى اسم الأسيتاميد ، وفقًا للاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC لمختصراته باللغة الإنجليزية). تجاريا يطلق عليه حامض الخليك أميد. يطلق عليه أميد لأن النيتروجين مرتبط بمجموعة الكربونيل. إنه أساسي ، لأنه يحتفظ بذريتي الهيدروجين المرتبطة بالنيتر
تفاعل Maillard هو الاسم الذي يطلق على التفاعلات الكيميائية بين الأحماض الأمينية وتقليل السكريات التي تحجب الطعام أثناء التحميص والخبز وتحميص القلي. تتشكل المركبات البنية المسؤولة عن لون ورائحة المنتجات مثل قشرة الخبز ولحم البقر المشوي والبطاطس المقلية والكعك المخبوز. يكون التفاعل مفضلاً بواسطة الحرارة (درجات حرارة تتراوح من 140 إلى 165 درجة مئوية) ، على الرغم من أنه يحدث أيضًا بسرعة أقل ، في درجة حرارة الغرفة. كان الطبيب والكيميائي الفرنسي لويس كاميل ميلارد هو الذي وصفها في عام 1
كلوريد الألومنيوم أو ثلاثي كلوريد الألومنيوم (AlCl 3 ) هو ملح ثنائي يتكون من الألومنيوم والكلور. في بعض الأحيان يظهر كمسحوق أصفر لأنه يحتوي على شوائب بسبب وجود كلوريد الحديد (III). يتم الحصول عليها من خلال الجمع بين عناصرها. يميل الألومنيوم ، الذي يحتوي على ثلاثة إلكترونات في مستوى الطاقة الأخير (العائلة IIIA) ، إ
حمض الكربوكسيل هو مصطلح يعزى إلى أي مركب عضوي يحتوي على مجموعة كربوكسيل. يمكن الإشارة إليها أيضًا باسم الأحماض العضوية ، وهي موجودة في العديد من المصادر الطبيعية. على سبيل المثال ، يتم تقطير حمض الفورميك ، وهو حمض الكربوكسيل ، من النمل والحشرات الأخرى مثل خنفساء galerita. وهذا يعني أن النمل مصدر غني للحامض الفورميك. أيضا ، يتم استخراج الخل حامض الخليك ، ورائحة الزبدة الزنكية يرجع إلى حمض الزبد ، والأعشاب حشيشة الهر تحتوي على حمض الفاليريك وحمض Capric ، يتم الحصول على جميع هذه الأح
حمض الأندرونيك هو مركب عضوي ينتمي إلى تصنيف البايفوسفونيت ، وتحديدا تلك الموجودة في الجيل الثاني ؛ هذه هي تلك التي تحتوي على ذرات النيتروجين. يحتوي هذا المركب ، بالإضافة إلى باقي البايفوسفونيت ، على تشابه هيكلي عالي مع بيروفوسفات غير عضوي (PPi). بيروفسفات غير عضوي هو نتاج العديد من ردود الفعل الاصطناعية في الجسم. يتم تخزينه في العديد من أنسجة الجسم ، وقد وجد أن دمجه في العظام ينظم عملية التكلس والتمعدن. حمض الأندرونيك ، مثل PPi و bispho
حمض الفورميك أو حمض الميثانويك وهو أبسط وأصغر مركب من جميع الأحماض العضوية. يُعرف أيضًا باسم حمض الميثانويك وصيغته الجزيئية هي HCOOH ، حيث تحتوي على ذرة هيدروجين واحدة مرتبطة بذرة الكربون. اسمها مشتق من كلمة فورميكا ، والتي تعني في اللاتينية النملة. وجد علماء الطبيعة في القرن الخامس عشر أن أنواعًا معينة من الحشرات (فورميكيديا) ، مثل ال
حمض الطرطريك هو مركب عضوي له الصيغة الجزيئية COOH (CHOH) 2 COOH. لديها مجموعتين من الكربوكسيل. وهذا هو ، يمكن أن تطلق اثنين من البروتونات (H +). بمعنى آخر ، إنه حمض ثنائي البروتينات. أيضا ، يمكن أن تصنف على أنها حمض الألدريك (السكر الحمضي) ومشتق حمض السكسينيك. ملحه معروف منذ زمن سحيق وهو أحد المنتجات الثان
كلوريد الكالسيوم (CaCl 2) إنه ملح غير عضوي يتكون من الكالسيوم والمعادن القلوية الأرضية وهالوجين الكلور. يوجد في هذا المركب العديد من التفاعلات الإلكتروستاتيكية التي تحدد المظهر الخارجي لبلوراتها وبقية خصائصها الفيزيائية. أيضًا ، يكون دائمًا مصحوبًا بجزيئات الماء ، مكونًا هيدرات الصيغ العامة CaCl 2 · xH 2 O ، مع x = 0 ، 1 ، 2 ، 4 و 6. عندما يكون x = 0 ، فإن الملح يفتقر إلى الماء ويكون غير مائي ، ك
التفاعل الطارد للحرارة هو نوع من التفاعل الكيميائي يحدث فيه نقل الطاقة ، بشكل رئيسي في شكل إطلاق للحرارة أو الضوء. يأتي الاسم من البادئة اليونانية exo ، والتي تعني "للخارج" ؛ ومصطلح "الحرارية" ، والذي يشير إلى الحرارة أو درجة الحرارة. وبهذا المعنى ، يمكن أن تنقل التفاعلات الطاردة للحرارة أنواعًا أخرى من الطاقة إلى البيئة التي يتم إنشاؤها فيها ، مثل الانفجارات وطريقتها في نقل الطاقة الحركية والصوتية عند توسيع الموا
المحاليل الكيميائية هي ما يعرف باسم الخلائط المتجانسة في الكيمياء. وهي عبارة عن خليط ثابت من مادتين أو أكثر حيث تتحلل مادة (تسمى المذاب) إلى أخرى (تسمى المذيب). تعتمد المحاليل مرحلة المذيب في الخليط ويمكن أن توجد في المراحل الصلبة والسائلة والغازية. يوجد في الطبيعة نوعان من الخلائط: الخلائط غير المتجانسة والمخاليط المتجانسة. المخاليط غير المتجانسة هي تلك التي لا يوجد فيها توحيد في تكوينها ، وتختلف نسب مكوناتها من خلال عينات منها. في المقابل ، ال
يتكون الانحلال الحراري من عملية تحلل حراري حيث تتعرض المواد ذات الأصل العضوي في أغلبيتها العظمى لدرجات حرارة عالية في وسط خامل (بدون وجود الأكسجين). عندما يتم التعامل مع المواد العضوية عن طريق الانحلال الحراري ، يتم الحصول على المنتجات المستخدمة في المجال الصناعي. واحد من العناصر التي يمكن الحصول عليها هو فحم الكوك ، والذي يستخدم كنوع من الوقود مع الخصائص الصناعية. يمكنك أيضًا الحصول على biochar (المعروف باسم biochar) ، والذي يستخدم لتعديل أو تحسين التربة. يتسبب هذا التفاعل ف
الكيمياء الحرارية هي المسؤولة عن دراسة التعديلات الحرارية التي يتم إجراؤها في التفاعلات بين نوعين أو أكثر. يعتبر جزءًا أساسيًا من الديناميكا الحرارية ، التي تدرس تحول الحرارة وأنواع الطاقة الأخرى لفهم الاتجاه الذي تتطور به العمليات وكيف تتنوع طاقاتها. أيضا ، من الضروري أن نفهم أن الحرارة تنطوي على نقل الطاقة الحرارية التي تحدث بين جسمين ، عندما تكون في درجات حرارة مختلفة ؛ في حين أن الطاقة الحرارية هي تلك المرتبطة بالحركة العشوائية التي تمتلكها الذرات والج
نترات البوتاسيوم عبارة عن ملح ثلاثي مكون من البوتاسيوم والمعادن القلوية ونترات الأكسانيون. الصيغة الكيميائية لها هي KNO 3 ، مما يعني أنه بالنسبة لكل K + أيون ، يوجد أيون 3 - يتفاعل معه. لذلك ، هو ملح أيوني ويشكل أحد النترات القلوية (LiNO 3 ، NaNO 3 ، RbNO 3 ...). KNO 3 هو عامل مؤكسد قوي بسبب وجود أنيون النترات. بمعنى أنه يع
ديفينيل أمين مركب عضوي له الصيغة الكيميائية (C 6 H 5 ) 2 NH. اسمها يشير إلى أنه أمين ، وكذلك صيغته (-NH 2 ). من ناحية أخرى ، يشير مصطلح "ثنائي الفينيل" إلى وجود حلقتين عطريتين مرتبطتين بالنيتروجين. وفقا لذلك ، ثنائي فينيل أمين أمين عطري. في عالم المركبات العضوية ، لا ترتبط كلمة العطرية بالضرورة بوجود روائحها ، ولكن مع الخصائص التي تح
كلوريد السترونتيوم هو مركب غير عضوي يتكون من السترونتيوم والمعادن القلوية الترابية (السيد بيكامبارا) وكلور الهالوجين. نظرًا لأن كلا العنصرين لهما ديناميات كهربائية مختلفة تمامًا ، يكون المركب عبارة عن مادة صلبة أيونية لها تركيبة كيميائية هي SrCl 2 . لأنها مادة صلبة أيونية ، تتكون من أيونات. بالنسبة لحالة SrCl 2 ، فهي عبارة عن كاتيون Sr2 + لكل فصيلتين. تشبه خصائصه وتطبيقاته كلوريد الكالسيوم والباريوم ، مع اختلاف أن مركبات السترونتيوم نادرة نسبيًا
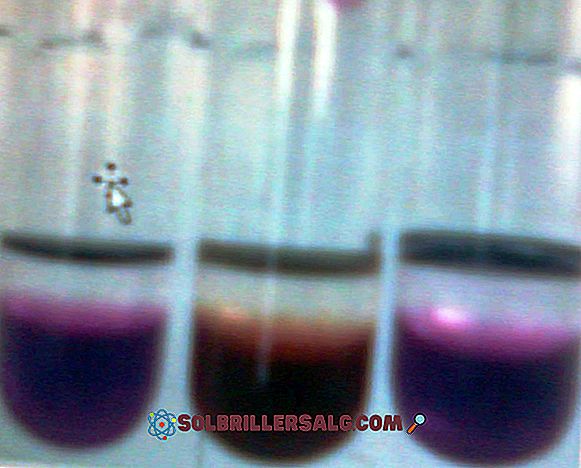
الفينول فثالين هو صبغة عضوية ، والتي بدورها حمض ثنائي البروتيك الضعيف ، وتستخدم في العديد من التحديدات الحجمية كمؤشر قاعدة الحمضية. وهذا هو ، إذا كان حمض ثنائي البروتيك ، في حل يمكن أن يفقد اثنين من أيونات H + ، ولكي يكون مؤشرا يجب أن يكون لديه خاصية كونه ملون في نطاق الرقم الهيدروجيني الذي يجري تقييمه. في الوسط الأساسي (الرقم الهيدروجيني> 8) الفينول فثالين وردي ، والذي يمكن تكثيفه إلى أحمر أرجواني (كما هو موضح في الصورة التالية). لاستخدامه كمؤشر قاعدة الحمضية ، يجب ألا يتفاعل بسرعة أكبر مع OH- من الوسط من التحليلات التي سيتم تحديدها. ب
برمنجنات البوتاسيوم (KMnO 4) هو مركب غير عضوي يتكون من مجموعة المنغنيز المعدني الانتقالي (VIIB) - الأكسجين والبوتاسيوم. بلونه الأرجواني الداكن الصلبة. المحاليل المائية هي أيضا الأرجواني الداكن. تصبح هذه المحاليل أقل البنفسج لأنها مخففة بكميات أكبر من الماء. يبدأ KMnO 4 بعد ذلك في إجراء تخفيضات (كسب الإلكترونات) بتتابع من الألوان بالترتيب ا
وأكسيد السترونتيوم ، الذي تركيبة كيميائية له هو SrO (لا يتم الخلط بينه وبين بيروكسيد السترونتيوم ، وهو SrO2) ، هو نتاج تفاعل الأكسدة بين هذا المعدن والأكسجين الموجود في الهواء عند درجة حرارة الغرفة: 2Sr (s) + O2 (g) → 2SrO (s). تحترق قطعة من السترونتيوم بالهواء نتيجة لتفاعلها العالي ، ولأن لديها تكوين إلكتروني من النوع ns2 ، فإنها تنتج بسهولة إلكترونات التكافؤ ، وخاصة جزيء ثنائي
الإلكترون التفاضلي أو التفاضلي هو آخر إلكترون يوضع في تسلسل التكوين الإلكتروني للذرة. لماذا اسمه؟ للإجابة على هذا السؤال ، فإن البنية الأساسية للذرة ضرورية: النواة والفراغ والإلكترونات. النواة عبارة عن مجموعة كثيفة مدمجة من الجسيمات الموجبة تسمى البروتونات ، وجزيئات محايدة تسمى النيوترونات. تعرف البروتونات الرقم الذري Z ، وكذلك النيوترون
هيدروكسيباتيت هو معدن فوسفات الكالسيوم ، الذي تركيبة كيميائية له هي Ca 10 (PO 4 ) 6 (OH) 2 . جنبا إلى جنب مع غيرها من المعادن والمواد العضوية لا تزال سحق والمدمجة ، فإنه يشكل المواد الخام المعروفة باسم الصخور الفوسفورية. يشير المصطلح "hydroxy" إلى OH. إذا كان الفلوريد بدلاً من ذلك الأنيون ، فسيُسمى الفلورأباتيت (Ca 10 (PO 4 ) 6 (F) 2 ، وهكذا مع الأنيونات الأخرى (Cl- ،
فوسفات المغنيسيوم هو مصطلح يستخدم للإشارة إلى مجموعة من المركبات غير العضوية التي تتكون من المغنيسيوم والمعادن الأرضية القلوية وفوسفات الأكسون. أبسط فوسفات المغنيسيوم له الصيغة الكيميائية Mg 3 (PO 4 ) 2 . تشير المعادلة إلى أنه لكل اثنين من الأنيونات PO 4 3- هناك ثلاثة كاتيونات Mg2 + تتفاعل مع هذه. أيضا ، يمكن وصف هذه المركبات كأملاح المغنيسيوم المستمدة من حمض ا
Pyrex glass هو زجاج البورسليكات الخاص الذي ظهرت علامته التجارية (Pyrex) في مدينة نيويورك في عام 1915 ، من إنتاج Corning Glass. ظهرت كمواد لتغليف المواد الغذائية الحديثة ، وتستخدم أيضا لتخزين وخبز الطعام في نفس النوع من الحاوية. نشأ أصل كلمة Pyrex عن بعض التناقضات ، لكن من المقبول أنها مشتقة من أكثر المقالات مبيعًا في اللحظات الأولى لتسويقها: صفيحة خبزت فيها الكعكة. مع هذا الزجا
Enantiomers هي تلك الأزواج من المركبات العضوية (وغير العضوية) التي تتكون من صورتين متطابقتين لا يمكن أن يتداخل أحدهما على الآخر. عندما يحدث العكس - على سبيل المثال ، في حالة وجود كرة أو نادٍ للجولف أو شوكة - يُقال إنها كائنات حمراء. صاغ المصطلح chirality ويليام طومسون (اللورد كلفن) ، الذي عرّف أن الجسم ما هو إلا إذا كان لا يمكن أن يتداخل مع صورة المرآة. على سبيل المثال ، الأيدي عناصر مراوغة ، لأن انعك
المعادن غير الحديدية هي جميع المعادن التي تفتقر أو تحتوي على كميات ضئيلة من الحديد. هذه ، بنسب كتل مختلفة ، تستخدم لإنشاء السبائك التي تظهر خصائص فيزيائية أفضل من المعادن الفردية. وبالتالي ، فإن الهياكل البلورية والتفاعلات المعدنية هي حجر الزاوية في تطبيقات السبائك غير الحديدية. ومع ذلك ، فإن هذه المعادن النقية تجد استخدام
الترسيب أو الترسيب الكيميائي هو عملية تتكون من تكوين مادة صلبة غير قابلة للذوبان من مزيج من محاليل متجانسة. على عكس هطول الأمطار والثلوج ، في هذا النوع من الأمطار "تمطر صلبة" من سطح السائل. في حلين متجانسين ، يتم إذابة الأيونات في الماء. عندما تتفاعل هذه مع أيونات أخرى (في وقت الخلط) ، تسمح تفاعلاتها الإلكتروستاتية بنمو بلورة أو مادة هلا
يشير الطابع المعدني لعناصر الجدول الدوري إلى جميع تلك المتغيرات ، الكيميائية والفيزيائية ، التي تحدد المعادن أو تميزها عن غيرها من المواد الطبيعية. فهي عادة ما تكون ساطعة ، كثيفة ، صلبة صلبة ، مع الموصلية الحرارية والكهربائية العالية ، قابلة للنمذجة والقذائف. ومع ذلك ، ليس كل المعادن يحمل هذه الخصائص ؛ على سبيل المثال ، في حالة الزئبق ، هذا سائل أسود ساطع. أيضا ، هذه المتغيرات تعتمد على ظروف الضغط ودرجة الحرارة على الأرض. على سبيل المثال ، يمكن للهيدروجين ، غير المعدن
أملاح الديازونيوم هي مركبات عضوية فيها تفاعلات أيونية بين مجموعة الآزو (-N 2 +) وأنيون X- (Cl- ، F- ، CH 3 COO- ، إلخ). الصيغة الكيميائية العامة لها هي RN 2 + X- ، وفي هذا يمكن أن تكون السلسلة الجانبية R إما مجموعة أليفاتية أو مجموعة أريل ؛ وهذا هو ، حلقة العطرية. يتم تمثيل هيكل أيون arenodiazonium في الصورة السفلى. تتوافق الكرات الزرقاء مع مجموعة الآزو ، بينما تشكل الكرات السوداء والبيضاء الحلقة العطرية لمجموعة الفينيل. مجموعة الآزو غير
المعادن الحديدية هي تلك التي تحتوي على الحديد (الحديد) ، وكذلك كميات صغيرة من المعادن الأخرى التي تمت إضافتها لإعطاء بعض الخصائص المفيدة لسبائكها. على الرغم من إمكانية وجود الحديد في حالات الأكسدة المختلفة ، إلا أن + 2 (حديدية) و +3 (حديديك) هما الأكثر شيوعًا. ومع ذلك ، يشير المصطلح "حديدية" إلى وجود الحديد بغض النظر عن حالة الأكسدة في المادة. الحديد هو العنصر الرابع الأكثر وفرة في قشرة الأرض ، لكنه على المستوى العالمي هو العنصر الأرضي الرئيسي. لذل
نظرية النطاق هي النظرية التي تحدد التركيب الإلكتروني للمادة الصلبة ككل. يمكن تطبيقه على أي نوع من المواد الصلبة ، ولكنه في المعادن تنعكس فيه أعظم نجاحاته. وفقًا لهذه النظرية ، ينتج الارتباط المعدني عن الانجذاب الكهربائي بين الأيونات الموجبة الشحنة والإلكترونات المتنقلة في البلورة. لذلك ، فإن البلورة المعدنية لها "بحر من الإلكترونات" ، والتي يمكن أن تفسر خواصها الفيزيائية. الصورة السفلى توضح الرابط المعدني. يتم فصل النقاط الأرجوانية للإلكترونات في بحر يحيط بالذرات المعدنية المشحونة إيجابياً. يتكون &q